原文:A review of optical breast imaging: Multi-modality systems for breast cancer diagnosis
Published in final edited form as: EurJRadiol. 2020 August ; 129: 109067. doi:10.1016/j.ejrad.2020.109067
文章不是文献的完全翻译,只对主要观点与思路进行阐述。
摘要:
文章重点关注多模态平台和最近的临床试验结果。 超声引导的漫反射光学断层扫描以及联合配准的超声和光声成像系统被强调为最有利于临床转化的最先进光学技术的模型。
- 超声引导扩散光学断层扫描;
- 光声成像;
- 数字乳房断层合成-扩散光学断层扫描;
- MRI - 扩散光学断层扫描;
1、绪论
X 射线乳房 X 线摄影是筛查和诊断成像的主要成像方式 ,但在放射学致密的乳房成分的设置中降低了敏感性。
乳房超声被广泛用于诊断成像,并被提倡对乳房致密的平均风险女性进行补充筛查,导致每 1000 名接受筛查的女性增加 2-7 例癌症检测 (ICDR) 。
包括分子乳腺成像 (MBI)、对比增强乳腺摄影 (CEM)、简略 MRI (ABMR) 和传统 MRI 在内的功能模式在致密乳腺的补充筛查中显示出更高的癌症检出率,每 1000 名女性中有 8-18 例癌症。
已建立的乳房成像方式也因过度诊断和低阳性预测值而处于不利地位。
光学成像提供有关乳房异常血管环境的功能信息,从而具有识别生物活性疾病的潜力,即限制过度诊断,并提高诊断准确性。它不需要静脉注射,不发射电离辐射,具有非常低的医疗风险,本质上成本较低。
漫射光学成像起源于乳房透照,其中乳房表面受到广谱“白”光的点光源,并显示透射过乳房的光。
1929 年,卡特勒在 174 个病灶中报告了第一次乳房透照的临床经验,并描述了 8 种不同病理实体和临床表现的特征性发现 [19]。 Cutler 于 1931 年发表了具有代表性的实体瘤透照图像[20]
通过将透射光的波长缩小到红色和近红外 (NIR) 光谱来解决广谱光穿透乳房组织的能力差的问题。光学乳房成像随着光谱变窄的进一步改进而发展 介入组织的吸收和散射特性。 通过这种方式,可以量化四种主要的组织成分,包括:水、脂肪以及含氧和脱氧血红蛋白 [23,24]。 在漫射光谱 (DOS) 和漫射光学断层扫描 (DOT) 的情况下,特定波长的 NIR 光通过光学“传输”光纤传输到乳房,并且发射的光(传输和散射)由一系列 光纤“接收”光纤 [25,26]。
Bell 在 1800 年代后期 [27] 首次描述了光声效应 - 将光转换为声音。与漫射光学成像相比,光声成像 (PAI) 透射的 NIR 光被组织吸收,导致热弹性膨胀并导致发射声压波,该声压波由超声换能器检测。
这两种光学技术通过识别总血红蛋白增加的乳房异常来提供有用的临床信息,总血红蛋白可作为增加和/或改变血管的替代物。 由于波长特异性吸收,DOS/DOT 可以量化组织的总血红蛋白 (THb)、氧合血红蛋白和脱氧血红蛋白。 类似地,如果使用两个或更多个光波长,则可以使用光声波来计算相对血红蛋白浓度和血氧饱和度 (sO2)的分布.一般来说,乳腺癌的 THb 高于良性异常或正常乳腺组织 [34,35],这可能反映了肿瘤血管生成。 随着组织从增生转变为异型性再到原位癌再到浸润性癌,增加的代谢需求会造成缺氧并引起血管生成 [36,37]
在这篇综述的正文中,我们简要讨论了光学成像的物理原理,并总结了 DOT 和 PAI 的技术进步,包括传统成像和光学成像模式的结合。 我们展示了每种多模态光学技术最有影响力的临床试验结果。 最后,我们专注于美国指导的 DOT 和共同注册的 US-PAI 方法,作为有利于临床转化的最先进光学技术的模型
1.1 光学成像原理
光子通过吸收和散射与组织相互作用。
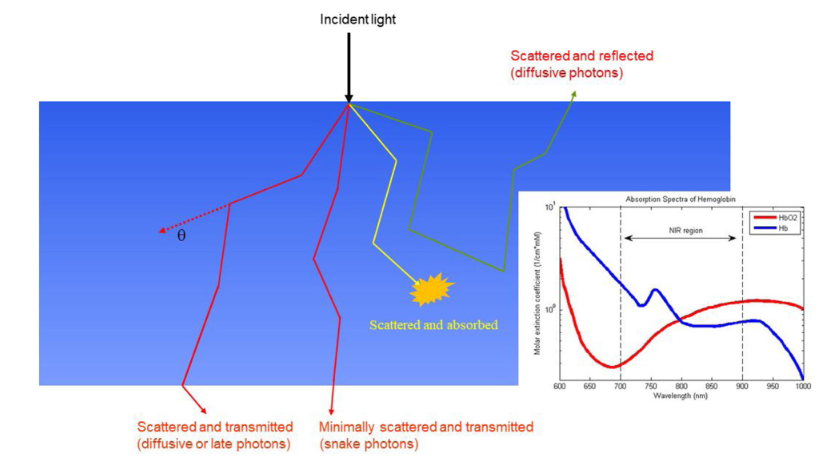
弹道光子、蛇形光子和漫射光子是指光子通过组织传输的路径。 弹道光子沿着直线路径传播而不会被散射,蛇形光子沿着准直线路径传播,只有少数散射事件,而漫射光子沿着随机之字形路径传播,有许多散射事件。 某些分子,如含氧和脱氧血红蛋白吸收特定波长的光,称为发色团。 大多数接收到的光来自散射。 组织光学特性的准确恢复需要对穿过组织的光扩散进行数学建模[25],并受益于传统成像方式提供的组织成分和病变位置的先验知识。
1.2 DOS - DOT
DOS 测量来自组织表面的入射 NIR 光的反射光子,并基于光扩散模型 [23] 拟合组织光学吸收和散射特性,而 DOT 测量透射或反射光子并使用断层扫描重建算法来成像空间吸收和/或 散射分布 [25,39,40]。 重建算法主要基于光扩散方程,它是生物组织中光子传输的近似值。 重建过程从在组织表面进行的透射和/或反射测量恢复损伤光吸收和/或散射特性。 DOS 系统通常由几对光源和检测器组成,用于估计生物组织的平均光学特性。该系统简单且成本低,但成像能力有限[23]。 而 DOT 系统具有 3-D 图像功能并且更详细地呈现。
基于不同的光源和检测技术开发了四种类型的 DOT 成像系统:时域 (TD)、频域 (FD)、连续波 (CW) 以及混合 FD 和 CW 系统。
- TD 漫射光学技术使用皮秒激光脉冲照亮组织,并从多个检测器收集被称为时间点扩展函数 (TPSF) 的接收光子的时间分布 [41-43]。系统的复杂性和高成本阻碍了 TD 系统的普及。
- FD 系统以高频(> 50 Mhz)直接调制光源的幅度,检测器测量发射信号的幅度和相移的降低。FD 系统通常采用一个调制频率和许多光源,这些光源由多个波长和许多具有更宽光谱和频率带宽的检测器组成。 在每个检测器处检测到的每个波长的信号与直接从源获得的外部参考进行比较,以提供幅度和相位测量。
- CW 系统以恒定强度或低频调制(几 kHz)发射 NIR 光,以提高信噪比。 检测器测量传输信号幅度的降低 [46]。 具有多波长激光二极管和密集光源和探测器阵列的 CW 系统已经开发并用于临床研究 [47-49]。
频域系统需要快速响应检测器,通常是光电倍增管或硅雪崩光电检测器以及高频检测电路。 然而,CW 系统只需要响应速度较慢的光电探测器和低频电路。 因此,CW系统的成本和复杂度远低于FD系统。 因此,在 CW 系统中使用了更多的源和检测器 [49]。 然而,仅使用来自 CW 系统的振幅数据进行定量光学重建是有限的,临床应用在很大程度上仅限于跟踪乳房异常的动态变化 [47,48]。 FD 和 CW 系统已被结合起来,以克服 CW 系统的重构限制以及 FD 系统的成本和复杂性 [50]。
未知组织光学吸收和散射 X 的成像重建主要基于逆优化方法,该方法迭代地搜索组织的吸收和散射分布,同时最小化来自组织的测量值 Y 和正向计算之间的误差 测量 f(X)。 前向测量基于从 TD、FD 或 CW 扩散方程计算的模型。 λ 是用于减轻解 X 的非唯一性或稳定性的正则化矩阵。通常实施停止准则以停止迭代并获得组织的估计吸收和散射分布 X。 血红蛋白分布(含氧、脱氧和 THb)是根据所用波长的已知消光系数从选定波长处的吸收分布计算得出的 [25,51]
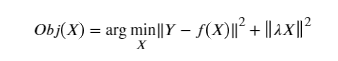
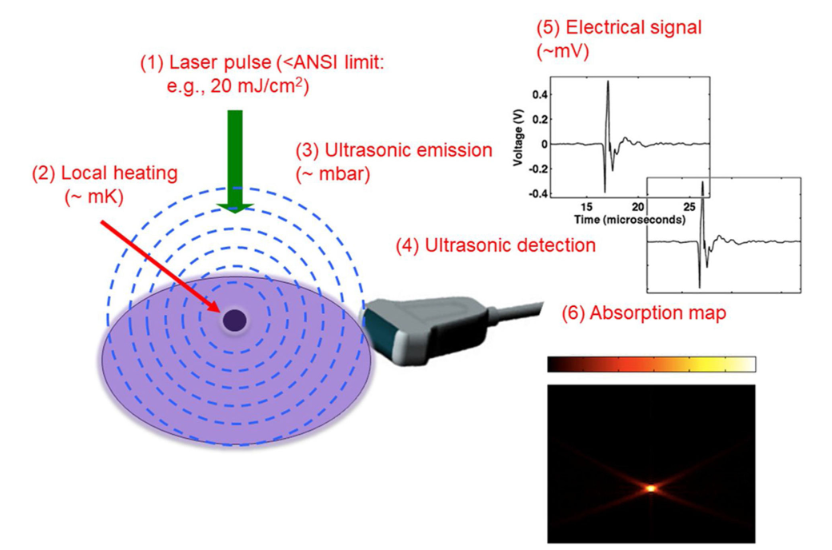
1.3 PAI
PAI 是一种混合成像技术,它使用 NIR 范围内的纳秒激光脉冲来激发组织,然后组织会经历热弹性膨胀并产生以声波(或光声波)形式分散的热量。 声波被换能器阵列接收并量化为光学吸收分布,这反过来又揭示了光学对比度。
光学对比度与微血管网络直接相关,当使用两个或多个光源波长时,可以绘制相对血红蛋白浓度和 sO2 的分布。 用于乳房成像的光声断层扫描系统可根据光照方法和光声检测方法分为两种主要配置:光声断层扫描 CT-PACT 和光声断层扫描 -PAT。
- 在 PACT 中,纳秒脉冲照亮宽视场,并且可以从投影中重建 2D 横截面图像,类似于 X 射线 CT,从乳房周围的环形换能器阵列或线性或弯曲线性阵列接收。 当换能器被机械平移或布置以在 3D 空间中获取数据时,可以获得 3D 体积图像 [30,52–56]。
- 在 PAT 中,纳秒脉冲照亮具有小视场的宽视场商用手持换能器,用于获取实时二维图像 [35,57–61]。
PACT 和 PAT 的穿透深度可随超声频率调节。 在 3-10 MHz 的诊断超声频率范围内,时间分辨率为 150-500 μm,PAI 在组织中的穿透深度在近红外光谱中可以达到 3-4 cm 或更大,这取决于激光功率和 背景组织光学特性。它可以很容易地使用手持式超声换能器,并且可以用于乳房成像工作流程。
在这篇综述中,我们将重点关注 PAT,因为它会对乳腺癌的诊断产生直接影响。 在下面的手稿中,我们将使用 PAI 来指代一般的光声成像,PACT 指的是使用 2D 阵列换能器的 3D 体积成像,而 PAT 指的是使用手持换能器的 2D 横截面成像。
每种光学成像技术都有优点和缺点。
DOT的优点是:
- 灵敏度高,无光声转换损失;
- 提供用于诊断的定量光学特性;
- 没有重大的安全考虑,即DOT激光二极管没有视力风险,除非用肉眼直接观察;
- 对较大的乳房病变进行成像的能力;
- US-guided DOT 随时适应现有的临床US系统。
DOT 面临的挑战包括:
- 由于组织中的强光散射导致分辨率降低;
- 非实时数据处理和时间密集型断层图像重建;
- 需要参考,例如校准体模或对侧正常乳房。
PAT的优点是:
- 空间分辨率高;
- 实时定性图像显示;
- 图像呈现,即病变脉管系统和 sO2 可以叠加在灰度 US 图像上,以创建用于解释的融合图像,这对于放射科医生来说是熟悉和直观的。
PAT 面临的挑战是:
- 图像特征是定性的,可能受读者可变性的影响;
- 背景组织吸收可能会产生混杂的图像伪影;
- 安全性——PAI 激光器要求操作者和患者佩戴防护眼镜;
- 临床适应性——目前 PAT 需要一个单独的 US/PAT 单元,而不是对现有临床设备的适应性。
1.4 多模态配准光学成像
DOT 和 PAI 系统利用类似的各种乳房定位和成像阵列几何形状进行数据采集和成像形成。 DOT 最初是作为一项独立技术开发的,并部署在三个不同的交付系统中。 独立的 DOT 系统或者将乳房夹在两个平行板之间,将源和探测器部署在乳房的相对两侧 [45,62–65],使用杯状几何形状,患者俯卧,乳房悬垂在液体介质中,或者 与光源和探测器密切接触 [48,66-68] 或使用包含光源和探测器的手持探头,利用反射几何 [69-71]。
PACT 也被开发为使用类似乳房定位几何形状的独立系统:俯卧位,下垂乳房在平面(类似乳房 X 线照相术)几何形状中轻微压缩,俯卧下垂乳房在半圆柱形杯内轻微压缩,俯卧未压缩乳房与径向( 球形或半球形)采集 [30,52–56]。 在俯卧位,下垂的乳房从底部照射,而在平面几何形状中,乳房从压缩乳房的任一侧或乳房两侧照射。 这些独立系统能够提供高分辨率 3D 体积图像,但是由于传感器的机械扫描,数据采集速度较慢。 需要进一步的技术发展来推进用于乳腺癌筛查的 PACT 系统。
在手持式成像几何结构中,患者处于仰卧位,乳房从一维手持式线性 US 阵列的两侧照射[57-61]。 B 扫描 PAT 图像可以通过使用延迟求和或反投影成像算法实时形成。 B 扫描 PAT 图像可以叠加在 B 扫描 US 图像上以进行联合配准。 由于换能器的视野有限,这些 PAT 系统的分辨率仅限于与深度相关的 US 分辨率。
DOT 的重建代表了一个典型的不适定逆问题,即大量具有未知光学特性和相对有限数量的测量的成像体素。 这需要将来自其他高分辨率成像模式的组织成分和病变位置的先验信息纳入 DOT 逆问题,以获得准确且可行的解决方案 [72-74]。
- 使用从高分辨率成像模式获得的解剖信息将成像体积分割为病变区域和背景组织区域,以减少具有未知光学特性的体素数量 Xin 前向模型 f(X ) [72];
- 使用直接分割的成像体积或高分辨率灰度图像在逆优化方法 [73,73,74] 中给出的重建中施加正则化 λ。
- 多模态方法将来自传统成像的补充解剖(即结构)信息与来自光学成像的生理(即功能)信息相结合。
与 DOT 不同,PAI 本质上涉及两种模式:NIR 光传输和吸收以产生光声波,以及 US 接收发射的光声波。 图像对比度与组织光学特性有关,而图像分辨率取决于 US。 尽管 US 具有内在用途,但早期的 PACT 系统本质上是独立设备,没有利用临床成像方式来定位或定义感兴趣的解剖区域 [33]。 随后添加的定位模态,即灰度 US [35,61],允许解剖光学图像融合以进行解释。
2. 临床结果
2.1 联合注册数字乳房断层合成 (DBT) -DOT
- (1)通过提供来自 DBT 的先验结构信息来改进 DOT 重建算法;
- (2)提高诊断准确性 DBT 通过添加从 DOT 收集的功能信息。
与现有光学文献相比,低 THb 值可能是由于乳房 X 线摄影压缩。 来自达特茅斯学院的 Michaelson 及其同事研究了 27 名乳房 X 光检查正常且乳房成分不同的女性,证明了乳房成分(即 X 线乳房密度)与 THb(r = 0.64,p = 0.001)、水(r = 0.62,p = 0.003)和 脂质浓度(r = -0.74,p < 0.001),但与 sO2 无关 [75]。 压缩和最小压缩采集的比较表明,由于压缩,sO2 显着下降(58 % 对 50 %,p = 0.04)。2011 年,Fang 及其同事证明了恶性和良性正常女性之间的光学特性存在显着差异。
基于这些研究,现在公认 THb 在压缩状态下较低,与乳房密度相关并具有区分恶性肿瘤的能力。
2.2 MRI - DOT 联合成像
Ntziachristos 及其同事报告了 MRI 引导的 DOS 的第一项临床研究 [84]。乳房在两块板之间被轻压,两块板包含光纤和射频线圈,用于共同配准。 TD 系统用于将两到三个 NIR 波长传输到 24 根光纤,检测板上有 8 个光学检测器。 源和检测器光纤均为 10 m 长,因此 DOT 系统可以避免干扰 MR 扫描仪。 该混合系统利用 MR 结构图像作为先验信息,并量化了体内 5 个恶性和 9 个良性乳腺病变的血红蛋白。 一般来说,恶性异常比良性病变具有较低的sO2和较高的血红蛋白浓度。
2006 年,来自达特茅斯学院的 Brooksby 及其同事开发了一种宽带 MRI 引导 DOT 系统,该系统具有 6 个激光二极管源光纤和 15 个检测器光纤,分布在一个环形结构中,并报告了 11 个正常受试者的结果 [85]。 环形系统位于开放式乳房 MRI 线圈内,以允许沿着悬垂乳房的长度定位。 整个数据采集不到 10 分钟。在符合光学数据敏感性标准的 30 项检查的子集中,MR 引导的 DOT 使用 THb (p < 0.01) 和定义为 THb × 水/脂质 (TOI, p < 0.001) 的组织光学指数 (TOI) 区分恶性和良性病变 )。 结合 MRI 和 TOI 数据产生了最佳的诊断性能。
在 2017 年同一组最近报道的一项研究 [94] 中,同时对 24 名患有 16 种恶性和 8 种良性异常的受试者进行了 MRI 成像,包括 T2 加权、弥散加权 (DWI) 和动态对比增强序列 (CEMRI) 和 DOT 在活检之前。 DOT 由 CEMRI 和非对比 MRI 引导,使用 T2 加权序列进行引导。 作者发现,将非对比 (T2-DWI) MRI 与 T2 引导的光学成像相结合时,结果最为准确。

这表明无需对比剂即可实现相似或更好的诊断准确性。 表 1 总结了 DBT 和 MRI 引导的 DOT 在 20 多名患者的临床试验中的结果测量和关键结果。
联合注册的 MRI - DOT,尤其是 T2 加权 MRI 引导的 DOT 的创新,在区分乳腺癌方面显示出前景,但仅在少数小型试点研究中进行了评估。创建兼容 MRI 的设备或延长光纤长度以允许光学控制台位于高磁场之外。 再加上 MRI 访问受限和费用高的缺点,使得联合注册的 MRI-DOT 不太可能用于近期临床实施。
2.3 超声引导的DOT
Zhu 等人报道了第一个由超声引导的 DOT 患者研究。 2003 年第一代超声制导频域 DOT 原型系统将商用超声换能器安装在一个蛤壳状光学探头内,该探头由 12 个双波长(780 nm 和 830 nm)光耦合器和 8 个检测光纤组成。 超声发现影像学异常和 DOT 同时绘制血红蛋白含量。 每个共同注册的数据集在大约 2-3 秒内获得。 使用该系统进行的两项研究的初步结果涉及 84 名患者的 100 处影像学异常,包括 10 处早期浸润性癌和 90 处良性病变 [78,79]。 恶性异常的总血红蛋白浓度大约是良性异常的两倍(p < .001),并且与 THb 分布图上更分散的分布相比,具有局部的 THb 分布。 US-DOT 的性能大大优于彩色多普勒 US [79]
随后,在 466 名接受影像引导穿刺活检的女性中进行了两项更大规模的试验,并使用第二代和第三代超声引导的频域 DOT 原型系统。两项研究再次证明恶性(比良性)异常中的 THb 显着更高,并显示较低阶段(Tis-T1)与较高阶段(T2-4)恶性肿瘤之间的差异,图4和图5显示了恶性和良性对象的典型例子。
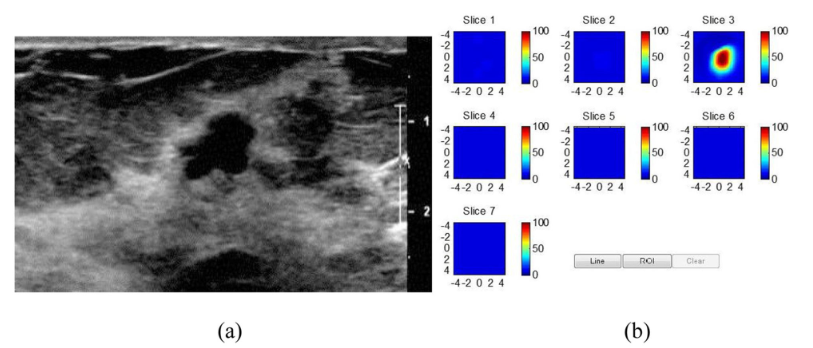
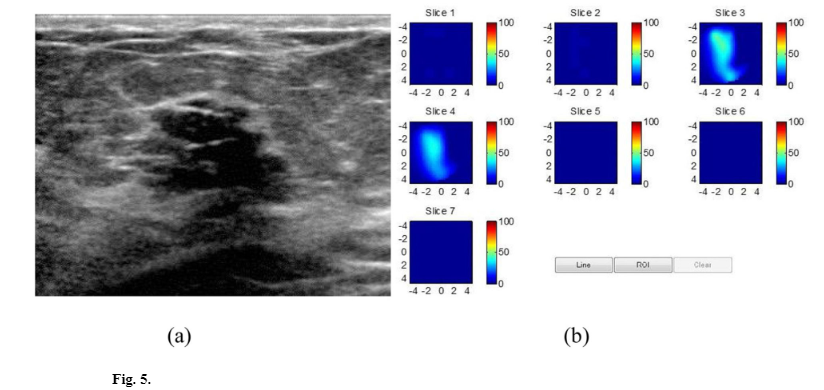
在疾病类别和确定的良性病理组中,例如纤维腺瘤、脂肪坏死和炎症状况以及伴有和不伴有非典型性的增殖性疾病作为假阳性的来源。添加 THb 可能有助于识别可疑的非血管病变和表征可能的良性血管病变 [95]。
基于来自多个研究者的这些研究以及从不同 DOT 系统获得的数据,人们普遍认为,超声引导的 DOT 证明 :
- 恶性乳腺病变中的肿瘤血管对比度高于良性病变;
- 血管对比度与肿瘤侵袭性相关;
- 某些良性病变的血管对比度远低于其他病变,可以安全地用于减少良性活检。
然而,为了将超声引导的 DOT 整合到临床乳腺研究流程中,需要将 DOT 系统小型化,并将其数据处理和图像重建速度提高到接近实时的操作。
2.4 超声与光声融合
联合成像的 US-PAI 的早期试点临床结果包括类似乳房 X 线照相术和手持几何学。 2016 年 Asao 等人。 报告了幻影结果,并显示了在单个浸润性导管癌患者中使用俯卧 US-PACT 系统的可行性,该系统将下垂的乳房压缩在平行板之间 [99]。 每次扫描后,美国换能器以 10 毫米的增量水平垂直平移扫描乳房。 图 6 给出了该系统的一个示例。2017 年和 2018 年报告的两个共同注册的 US-PAT 手持原型设备的小型试验显示了类似的结果 [58,60]。 贝克尔等人。 对 6 名健康志愿者、5 名患有浸润性癌的女性和 2 名患有 DCIS 的女性进行了成像,结果显示浸润性癌和正常对照组之间的血红蛋白和 soO2 存在差异 [60]。 使用类似的设备 Diot 等人。 显示 10 名浸润性癌患者的肿瘤血容量高于背景 [58]。 迪恩-本等人。 证明了以纤维腺体为主的致密乳房的年轻健康志愿者揭示了以视频速率呈现代表血管解剖和功能性血氧参数的三维图像的可行性 [59]。
在欧洲多中心试验中,作者评估了联合注册的 US-PAT 在常规 SOC 超声的基础上正确降级评估为低或中度怀疑(BIRADS 4A 或 4B)的良性肿块的能力。 在具有 215 个 BIRADS 4A 或 4B 乳房肿块的 209 名患者中,联合注册的 US-PAT 正确地将 47.9% 的良性肿块归类为低怀疑 4A 和 11.1% 的肿块归类为中度怀疑 4B。 67 个 (4.5 %) 恶性肿块中有 3 个被错误地降级,包括 7 个低怀疑肿块中的两个 (BIRADS 4A) 和 60 个中度怀疑肿块 (BIRADS 4B) 之一。
更大规模的美国试验的目的是比较联合注册的 PAT 信息与单独的灰度超声在区分良性和恶性超声可见肿块方面的诊断准确性 [35]。 基于五项 PAT/US 影像学特征,良性病理学相关影像学评分显着低于恶性病理学。 此外,恶性肿瘤的概率随着特征评分的增加而增加。 边界和外围(而不是内部)评分与恶性肿瘤高度相关。
2018 年发表了两项源自美国多中心 Seno Medical 试验最初 100 个“培训”案例的后续研究,也显示了有希望的结果 [100]。 在一项试验中,PAT/US 的敏感性与内部 US 的敏感性相比没有变化(97.1% 对 97.1%),而 PAT/US 的特异性提高到 44.3%(对 36.4% - 灰度 US)。 在另一项研究中,PAT/US 特征分析再次证明,外部特征比内部特征更具预测性的恶性肿瘤得分更高。
除了已证明对减少良性活检的临床影响外,共同注册的 US-PAT 还具有其他理想的临床特征。 如上所述,它已经商业化(Imagio™,Seno Medical Instruments),因此可用于临床实施。 组合系统方便地允许在同一检查期间执行传统的 US 和 PAT。 此外,光学参数可以叠加在传统的超声图像上以提供融合的图像图,为解释放射科医师提供熟悉的图像格式。 然而,Imagio™ 是一个集成的 US/PAT 单元,具有特殊超光声换能器和硬件,而不是对现有临床乳腺超声单元的改编。 用 Imagio™ 取代商业乳腺超声系统是一个巨大的挑战,需要未来的临床试验来证明额外的好处是合理的。
3. 总结
传统的乳房 X 线摄影和超声成像具有几个重要的局限性,这为扩散光学断层摄影和光声成像等辅助成像技术创造了一个利基。 光学成像提供有关肿瘤相关血管的功能信息,通常显示恶性肿块中 THb 升高和 sO2 降低。 传统成像与光学成像相结合,提高了光学成像数据,具备了图像配准的能力。
所有共同注册的传统光学系统都有优点和缺点。
- 联合注册的数字乳房断层合成 (DBT) -DOT 可以区分指定感兴趣区域的恶性肿瘤和良性异常,但作为辅助筛查工具具有未开发的潜力,因为包括整个乳房并且 DBT 筛查已经确立。 然而,需要更多的研究来确认压缩状态下的诊断准确性,并且需要新的设计和相关研究来评估在提高 DBT 筛查准确性方面的潜在作用。
- 联合 MRI - DOT 系统已被证明可以提高乳房 MRI 的诊断准确性,并有可能提高 MRI 的特异性,尤其是在 t2 加权 MRI 引导的 DOT 技术下。 然而,由于其获取途径有限且成本高昂,MRI 并未用作乳腺成像中的主要筛查或诊断方式,需要更多的临床研究来验证联合注册的 DOT - MRI 的潜在益处,以证明其必要性。 此外,创建兼容 MRI 的光学设备存在后勤障碍。
- 来自超声引导的 DOT和 US-PAT 的初步试验表明,能够显着(大约 45%)减少良性超声可见肿块的不必要活检,从而大大提高活检建议的阳性预测值。 如果其中一种或两种技术可以在 3 期试验中得到验证,这可能会显着减少与假阳性活检建议相关的焦虑和轻微发病率,并转化为患者、医疗保险公司和整个社会的大量成本节约。 此外,正在出现将光学参数与肿瘤生物学标志物相关联的令人鼓舞的数据。
超声引导的 DOT和 US-PAT 技术正在快速成熟,其中一种或两种技术的临床采用很可能在不久的将来出现。
DBT-DOT 将需要进一步的临床研究来验证恶性和良性乳腺异常之间的光学对比是否可以在压缩下保留,因此可以与 DBT 协同使用以改善乳腺癌的诊断。
联合注册的 MRI - DOT 还需要进一步的临床研究,以验证将额外的 DOT 系统集成到 MRI 中以改善乳腺癌诊断的好处。
PACT 有望用作独立的筛查模式,需要进一步开发以提高数据采集速度和乳腺癌筛查的渗透深度。
光学造影剂的开发是一个活跃的研究领域,具有改善癌症检测的巨大潜力,DOT 和 PAI 具有更大的穿透深度 [103,104]。
与 X 射线、US、MRI 和 PET 的最初发展一样,不同研究实验室或公司构建的光学成像系统实施了不同的硬件、数据处理和成像重建软件。 因此,很难对从不同系统获得的患者研究进行交叉比较。 目前,FDA 正在努力标准化光学成像体模,以便不同的系统可以获取相同目标的图像以进行交叉比较。 随着有前景的光学成像技术的进一步发展,成像系统的标准化应遵循商业化。
参考文献:
[1]. Sprague BL, Arao RF, Miglioretti DL, et al. National performance benchmarks for modern diagnostic digital mammography: update from the breast cancer surveillance consortium, Radiol 283 (2017) 59–69.
[2]. Schunneman HJ, Lerda D, Quinn C, et al. Breast Cancer screening and diagnosis: a synopsis of the European breast guidelines, AnnInternMed 172 (2020) 46–56.










评论区